generate_data <- function(n = 200, hr1, hr2, hr3) {
stoma <- rbinom(n, size = 1, prob = 0.4)
sex <- rbinom(n, size = 1, prob = 0.5)
age <- rnorm(n, mean = 65 + 3 * stoma, sd = 8)
hazard_relapse <- 0.10*exp(stoma*log(hr1)+age*log(hr2))
# 再発のハザード(大きいほど早く起こる)
hazard_death <- ifelse(stoma == 1, hr3 * 0.10, 0.10) # 死亡のハザード(大きいほど早く起こる)
hazard_censoring <- 0.05 # 打ち切りハザード(群に依存しない)
t_relapse <- rexp(n, rate = hazard_relapse) # 再発までの潜在時間
t_death <- rexp(n, rate = hazard_death) # 死亡までの潜在時間
t_censoring <- rexp(n, rate = hazard_censoring) # 打ち切りまでの潜在時間
## --- 全生存期間(OS) ----------------------------------------
time_os <- pmin(t_death, t_censoring)
status_os <- as.integer(t_death <= t_censoring) # 1 = 死亡, 0 = 打ち切り
## --- 無再発生存期間(RFS) -----------------------------------
time_rfs <- pmin(t_relapse, t_death, t_censoring)
status_rfs <- integer(n)
status_rfs[time_rfs == t_relapse & time_rfs < t_censoring] <- 1 # 再発
status_rfs[time_rfs == t_death & time_rfs < t_censoring] <- 1 # 死亡
## --- 累積再発率(CIR) + 競合リスク --------------------------
time_cir <- pmin(t_relapse, t_death, t_censoring)
status_cir <- integer(n)
status_cir[time_cir == t_relapse & time_cir < t_censoring] <- 1 # イベント1: 再発
status_cir[time_cir == t_death & time_cir < t_censoring] <- 2 # イベント2: 競合リスクとしての死亡
## --- データフレームにまとめる --------------------------------
dat <- data.frame(
id = 1:n,
sex = factor(sex, levels = c(0, 1), labels = c("WOMAN", "MAN")),
age = age,
stoma = factor(stoma, levels = c(0, 1),
labels = c("WITHOUT STOMA", "WITH STOMA")),
time_os = time_os,
status_os = status_os,
time_rfs = time_rfs,
status_rfs = status_rfs,
time_cir = time_cir,
status_cir = status_cir
)
}From Risk and Rate to Survival and Hazard

Effects and Time V − From Risk and Rate to Survival and Hazard
Keywords: effect measure, probability model, R simulation, survival & competing-risks
リスクと時間の関係
私「お父さんさ、以前聞いた寄与割合の話を思い返して気づいたんだけどね。まだ納得感が足りないの」
お父さん「なに?コーヒーと一緒にこういう話をするのは歓迎だよ」
私「がん検診後、10年、12年、20年って見ていくと、寄与割合が変わるって話だったでしょ。リスクには時間の概念があるって。あれって、2値データじゃなくて生存時間データになってない?ていうか、あれは生存曲線か」
お父さん「そうだよ。リスクと生存曲線は表裏一体なんだ」
私「生存曲線からある時点の生存確率を読み取ると、1-リスクになっているっていう意味ね。うんうん。そして、疫学の教科書に出てくる率(rate)が、生存時間解析のハザード(hazard)に対応しているっていうのもわかる。でも、気になるのはハザード比(hazard ratio)なんだ。寄与割合とかリスク比とかって、時間とともに変化するっていうけど、ハザード比は変化しないんだっけ」
お父さん「変化しない。正確にいうと、生存曲線をみると変化している状況もあり得るんだけど、時間を通じてハザード比は一定と、無理やり仮定して計算してる」
私「リスク比は変化するけどハザード比は変化しないの?矛盾してない?」
お父さん「えーっと、リスク比が変化しないわけじゃなくて…。リスクはハザードの時間積分だから、どちらか一方の比を固定したらもう一方は固定できなくて…。ちょっと紙ナプキンとペンをとってくれる?教科書通りに説明するとこうなるんだけど。まずはリスクとハザードからはじめるね」
これまでのエピソードでは、ある時点までのリスクを扱ってきましたが、今度は“時間に沿って変化するリスク”を推定したKaplan-Meier曲線について正式に説明します。Kaplan-Meier曲線は、そもそも2値データではなく生存時間データに用いられる手法でした。そのため、Kaplan-Meier曲線は時間軸を横にとったグラフですし、いわゆるハザード比との関係も知りたいところですよね。ここでは、ハザードが時間を通じて一定という単純な状況で、そのあたりを整理しましょう。
Kaplan-Meier曲線は、生存時間データから計算された推定値を、時間軸(\(x\)軸)に沿ってグラフにしたものです。これを数式で書くなら、「生存曲線を時間\(x\)の関数\(S(x)\)で表す」ということになります。
関数\(S(x)\)を具体的に書くこともできます。生存時間が、ハザードが時間を通じて一定ということは、指数分布に従うと仮定したことになります(これはKaplan-Meier曲線とは別ものです)。指数分布の形状を決めるパラメータ(ハザード)は、\(λ\)という記号で表すことが普通です。このとき指数分布の生存関数とハザードには、以下のような関係があります。
\(S(x)=\mathrm{exp}(-\lambda x)\)
ここまでくればあと一息です。最後に、疾患リスクとハザードの関係を確認しましょう。疾患リスク\(π\)は、特定時点\(x\)までに疾患を発症する確率を表しています。つまり、疾患リスク\(π\)とハザード\(λ\)は、時点\(x\)の生存関数を\(S(x)\)を介して、以下の式で結びついています。
\(\pi=1-S(x)=1-\mathrm{exp}(-\lambda x)\)
私「わからん。数式はわからん」
お父さん「そう?数学の難しさというより、この等式が何と何を結びつけているかが、慣れないと読み取りにくいんだと思う。ちょっとしたポイントは指数分布だとハザードは定数扱いで、生存関数は時間の関数だってところかなあ」
私「結びつきねえ。とりあえず生存曲線とハザードの関係式ってことまでかな、確実なのは」
お父さん「まずはそこからだね。多分、指数分布からデータを発生させるシミュレーションをやってみると、この式とデータの関係が見えてくると思う」
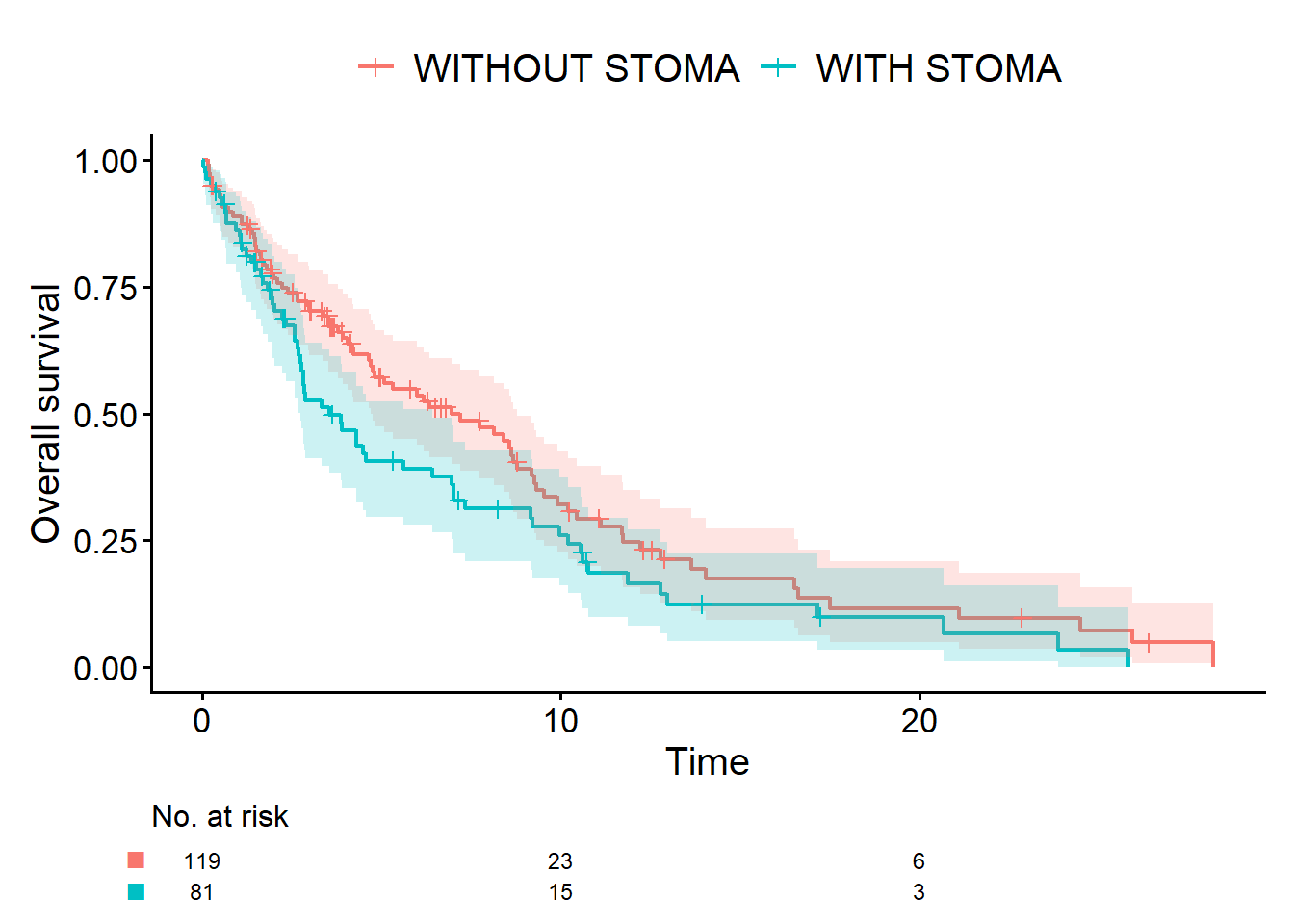
どのようなシミュレーションデータが得られるかイメージしやすいように、cifplot()で描いたKaplan–Meier曲線とcoxph()の結果を置いておきます。
# devtools::install_github("gestimation/cifmodeling") #インストールが必要なら実行
library(cifmodeling)
set.seed(46)
dat <- generate_data(hr1=2, hr2=1, hr3=1.5) #再発ハザード比2, 死亡ハザード比1.5のデータ生成
cifplot(Event(time_os, status_os) ~ stoma,
data = dat,
outcome.type = "survival",
label.y = "Overall survival"
)
# install.packages("survival") #インストールが必要なら実行
library(survival)
fit <- coxph(Surv(time_os, status_os) ~ stoma, data = dat)
summary(fit)Call:
coxph(formula = Surv(time_os, status_os) ~ stoma, data = dat)
n= 200, number of events= 144
coef exp(coef) se(coef) z Pr(>|z|)
stomaWITH STOMA 0.3199 1.3769 0.1693 1.889 0.0589 .
---
Signif. codes: 0 '***' 0.001 '**' 0.01 '*' 0.05 '.' 0.1 ' ' 1
exp(coef) exp(-coef) lower .95 upper .95
stomaWITH STOMA 1.377 0.7262 0.9881 1.919
Concordance= 0.544 (se = 0.024 )
Likelihood ratio test= 3.51 on 1 df, p=0.06
Wald test = 3.57 on 1 df, p=0.06
Score (logrank) test = 3.6 on 1 df, p=0.06私「ふむふむ。ハザードで指数分布を指定すると生存曲線が決まるわけね」
お父さん「そういうこと。次に気になるはハザードだよね。このパラメータの具体的なイメージを持つのは難しいけど、生存時間中央値と結びつけるのがよくやる手だよ。中央値(median)は生存曲線がちょうど50%まで落ちる時点のこと」
さて、ハザードは生存曲線が下がるスピードを決める数値です。生存時間がどのくらいの長さなのかは、中央値で測ることができます。生存時間中央値\(M\)は、生存確率50%つまり\(S(x)=0.5\)になるような時間\(x\)のことです。つまり、指数分布では
\(0.5=\mathrm{exp}(-\lambda M)\)
と関係が成り立つので、生存時間中央値\(M\)は、ハザード\(λ\)から以下のように計算することができます。
\(M = \frac{\log 2}{\lambda} \approx \frac{0.7}{\lambda}\)
私「あ、これはちょっとわかった気がする。寿命(生存時間中央値)とハザードが逆数の関係ってことね。つまり寿命が2倍になったらハザードは1/2になる」
お父さん「そうだね、たとえるならハザードはコーヒーにとっての気温みたいなもの。寒いとコーヒーがさめる時間が短くなる。これがハザードが高いってこと。正確に逆数になるのは、指数分布の下で計算するときだけどね。ハザード比は、まさにハザードの比をとったものだよ。指数分布ではこういう式になる。2つの集団の生存曲線を比較するときによく使うよね」
- 指数分布のハザード比 \[ HR=\frac{\lambda_1}{\lambda_2} \]
生存時間中央値を報告してよいのは、どのような場合でしょうか?
- 目安としてサンプルサイズが100人以上のとき
- すべての対象者が予定された追跡期間を終了したとき
- 半数以上の対象者がイベントを起こしたとき
- 1、2、3すべて誤り
- 正解は3です
生存時間データでは一部の対象者で打ち切りがあること(これ以上生存時間が長いことしかわからない)、中央値(median)の定義を思い出してください。半数以上の対象者がイベントを起こし、生存時間が確定しないと、生存確率は50%以下になりません。
次のエピソードとRスクリプト
このシリーズのエピソード
- Silent Confusions Hidden in Percentages
- Who Is This Percentage About? Target Populations and Attributable Fractions
- When Odds Ratios Approximate Risk Ratios—and When They Fail
- From Risk and Rate to Survival and Hazard
- A First Note on Cox Regression
- After Cox Regression: A Case Study and R Demonstration
過去のシリーズ
用語集